Osteonecrosi testa omerale
Con il termine di Osteonecrosi si intende una condizione patologica in cui Il tessuto osseo va incontro a necrosi. Tale grave evento si manifesta allorquando si produce una minore o perdita totale dell’ apporto di sangue alla testa omerale e per questo motivo viene chiamata anche “Necrosi Avascolare” (NAV ) o “Necrosi Asettica” (NAS). Più frequentemente è la testa femorale ad essere colpita ma può interessare ogni segmento osseo. Inizialmente descritta da Heimann e Freiberger (NEJM) nella testa omerale nel 1960. E’ il 2° sito di osteonecrosi più comune dopo quella della testa femorale. Nel tempo sviluppa una grave artrosi gleno/omerale (G/O). L'articolo affronta l'argomento alla luce delle più recenti acquisizioni
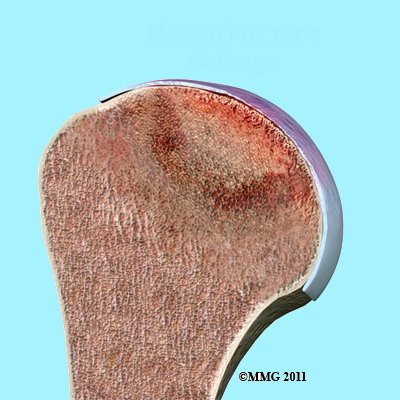
Con il termine di Osteonecrosi (Fig. 1) si intende una condizione patologica in cui Il tessuto osseo va incontro a necrosi (dal greco οστό = osso e νέκρωσις, necrosi = morte). Tale grave evento si manifesta allorquando si produce una minore o perdita totale dell’apporto di sangue alla testa omerale e per questo motivo viene chiamata anche “Necrosi Avascolare” (NAV ) o “Necrosi Asettica” (NAS). Più frequentemente è la testa femorale ad essere colpita ma può interessare ogni segmento osseo.
Inizialmente descritta da Heimann e Freiberger (NEJM) nella testa omerale nel 1960. E’ il 2° sito di osteonecrosi più comune dopo quella della testa femorale. Nel tempo sviluppa una grave artrosi gleno/omerale (G/O).
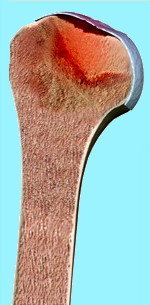
Fig. 1
Anatomia
L’articolazione di spalla è nutrita da grandi vasi sanguigni (Fig. 2) che forniscono un valido apporto di sangue alla spalla e a tutto il braccio. Uno dei vasi più importanti è l’arteria ascellare che è situata proprio nel cavo ascellare.
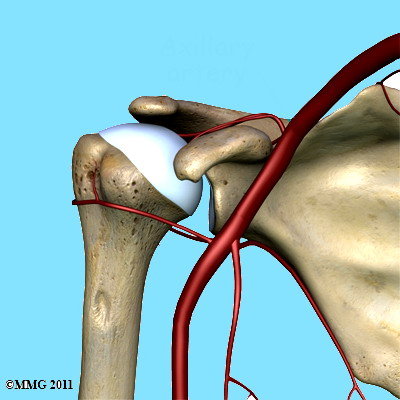
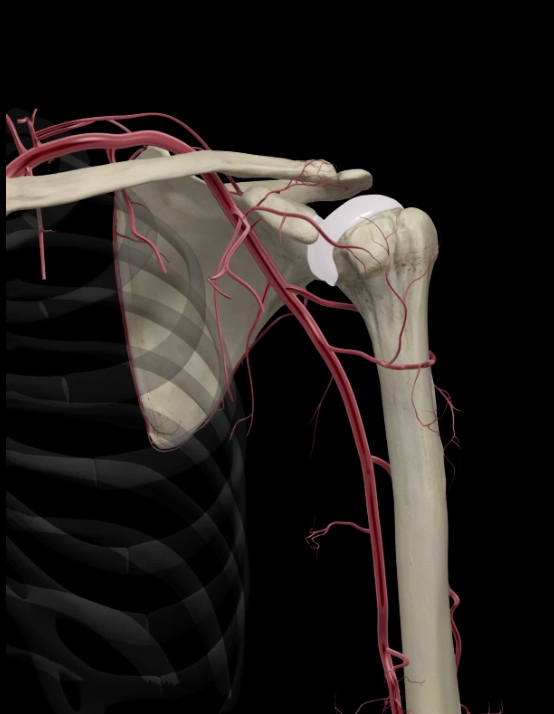
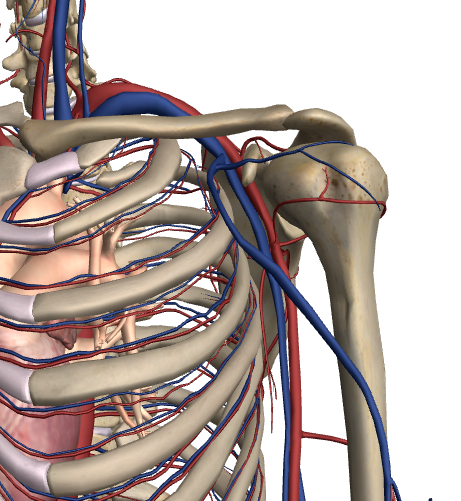
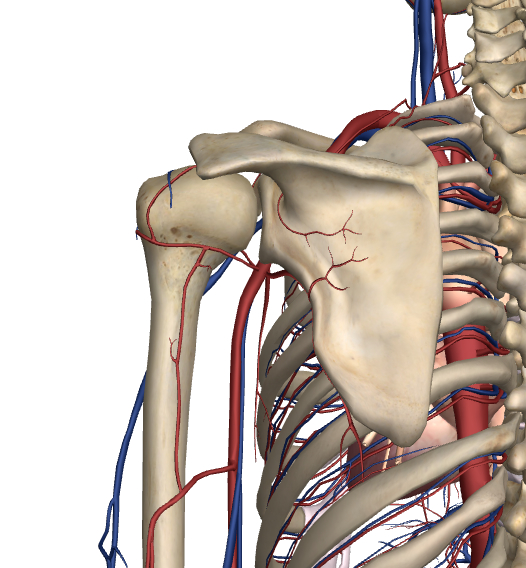
Fig.2
Questa grossa arteria ha dei rami più piccoli – arteria circonflessa anteriore e posteriore - che forniscono sangue in diversi distretti della spalla. Alcuni di questi vasi sono essenziali poiché una loro lesione compromette seriamente il sistema di irrorazione.
Epidemiologia ed eziopatogenesi
La fascia di età più colpita è quella compresa tra i 25 e 55 anni ma non si può escludere che possa manifestarsi a qualsiasi età.
Gli uomini sono interessati con una frequenza doppia rispetto alle donne anche se nel sesso femminile vi è più incidenza di osteonecrosi quando c’è una malattia autoimmune. Va sottolineato che una necrosi avascolare isolata della testa omerale è piuttosto infrequente ed in generale sono più comuni le forme multifocali (più distretti colpiti).
Le cause di osteonecrosi possono essere molteplici, di origine
- traumatica
- atraumatica
- idiopatica.
Tra le cause traumatiche si annoverano la frattura e la lussazione di spalla che possono produrre, come esito, la perdita più o meno grave dell’apporto di sangue sviluppando in questo modo l’osteonecrosi.
Tra le cause atraumatiche si annoverano tutte le patologie che implicano una insufficienza/perdita di sangue al tessuto osseo della spalla come l’uso smisurato di corticosteroidi; in associazione a malattie ematiche (anemia falciforme, trobofilia, ecc.), malattie dismetaboliche (diabete mellito, dislipidemia, ecc.).
Vi sono condizioni che in alcuni pazienti sviluppano un fattore di rischio maggiore rispetto ad una popolazione normale come ad esempio: l’abuso di alcool, l’uso di tabacco, la gravidanza, malattie infiammatorie intestinali, la chemioterapia e la radioterapia. Quando non si riconoscono cause ben precise si parla allora di causa idiopatica.
Nella Tabella 1 (qui sotto) il quadro sinottico delle cause di osteonecrosi della testa omerale

La morte del tessuto osseo della testa omerale di per sé non rappresenta il problema più grosso bensì l’attivazione di una serie di eventi che il corpo mette in atto per promuovere la guarigione. Le cellule ossee morte vengono rimosse da altre cellule chiamate macrofagi e contemporaneamente si attivano le cellule che producono nuovo osso (attività osteoblastica).
Tale meccanismo però non è equilibrato per cui il tessuto osseo morto è rimosso più velocemente di quanto tessuto osseo nuovo viene creato. Risultato di questo squilibrio è un collasso dell’impalcatura (Fig. 3) di sostegno alla cartilagine articolare e cedimento della struttura ossea portante l’articolazione.
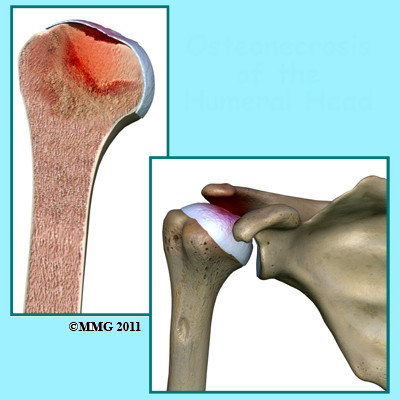
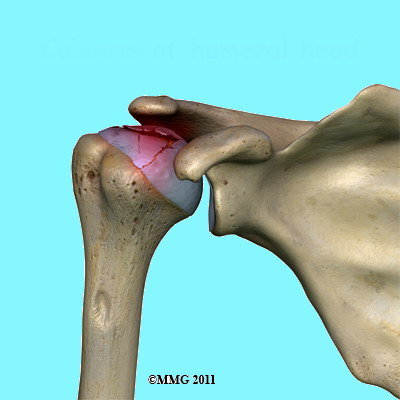
Fig. 3
Stadiazione
La stadiazione della patologiaè un criterioper seguireil suo sviluppoin modo dainiziare atrattare esattamente il paziente nelle varie fasi. Non ci sonoparametri cliniciofunzionali utilizzabili per la stadiazione poiché si basa esclusivamentesul cambiamento del tessuto osseorilevabile alle indagini radiografiche.
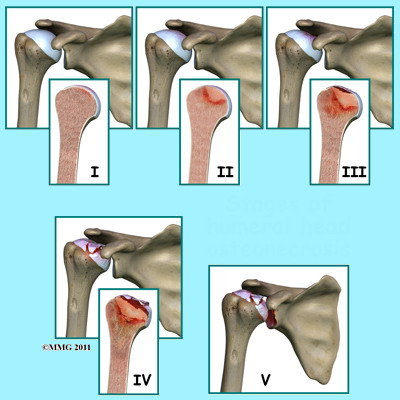
E’ utilizzato il sistema di classificazione di Cruess (1978) su base strumentale, modificato da Ficat & Arlet per la osteonecrosi della testa femorale.
Tabella 2 – STADI DI OSTEONECROSI - CLASSIFICAZIONE FICAT & ARLET
|
FASE |
DESCRIZIONE |
|
I |
Spalla funzionante con dolore incostante - Le modificazioni radiografiche non sono ancora visibili - La RM o Scintigrafia ossea possono rilevarla |
|
II |
Rimodellamento dell’osso con sclerosi subcondrale - Presenza di area di osteopenia - Ancora mantenuta la sfericità della testa |
|
III |
Segno di Crescent (frattura subcondrale) o collasso subcondrale - Minima depressione della superficie articolare |
|
IV |
Segno di appiattimento della superficie articolare e dell'osso subcondrale - Distruzione cartilaginea e frammentazione ossea - Corpi liberi endoarticolari - Artrite secondaria |
|
V |
Estensione alla componente glenoidea della scapola |
La classificazione di Ficat & Arlet è stata rivista alla luce dei nuovi elaboratissimi mezzi di indagine strumentale. Per tale motivo è stata proposta, nel 1993, la classificazione dalla ARCO (Association of Research Circulation Osseous) principalmente per la necrosi avascolare della testa femorale.
Sintomatologia
L’esordio della malattia è insidioso. In una fase iniziale la sintomatologia è molto sfumata. Il dolore può essere incostante ma durante il progredire della malattia, il dolore diventa continuo fino ad essere intollerabile soprattutto di notte, associandosi anche ad una rigidità di spalla di grado variabile. Il disagio più grande si manifesta a 90 gradi di elevazione/abduzione.
Il dolore rappresenta, quindi, il primo sintomo che da principio è discontinuo poi diventa sempre più costante anche al più piccolo movimento del braccio fino a essere presente anche a riposo. Si possono associare anche la percezione di rumori come scricchiolio e crepitio articolare.
Il paziente ha difficoltà a localizzare il punto preciso del dolore. Si manifesta con caratteristiche tipiche: martellante e profondo. Si può irradiare fino al gomito.
Le limitazioni al ROM (movimento della spalla) possono essere anche gravi fino a impossibilità di mettere la mano sopra la testa. Sono eccezionali i casi indubbi con un riscontro clinico assente, mentre è frequente l’associazione con manifestazioni in altri distretti anatomici.
Diagnosi
In caso di sospetto di osteonecrosi della testa omerale, lo scopo principale è quello di porre diagnosi il più presto possibile al fine di stabilire una precoce e adeguata terapia.
E’ fondamentale raccogliere la storia clinica completa poiché aiuta a identificare i fattori di rischio associati, che dovranno essere valutati e trattati durante il percorso della malattia al fine di ottenere risultati di maggior successo.
Sarà necessario esplorare anche altre articolazioni per eventuali patologie simili infatti, in circa la metà dei pazienti, l’osteonecrosi è presente a livello dell'anca, del ginocchio, della caviglia.Un altro dato importante è l’effettuazione di indagini di laboratorio al fine di escludere un'infezione; i test specifici per le malattie sistemiche e quelli per malattie del sangue che possono essere causa di osteonecrosi.
Nella fase iniziale, il sospetto diagnostico si acquisisce solo clinicamente e consiste nel dolore e nella limitazione funzionale dell’articolazione colpita che può essere, oltre la spalla, altresì le anche e le ginocchia e particolarmente in soggetti nei quali coesistono uno o più dei fattori predisponenti elencati nella tabella 1.
Non sempre sono ben identificabili le cause e in questo caso l’osteonecrosi si definisce idiopatica.
I mezzi diagnostici strumentali disponibili in questo momento sono:
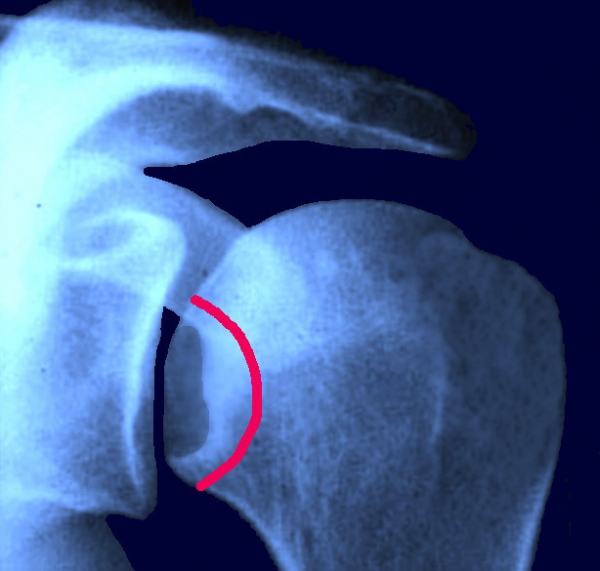
- Radiografia – è fondamentale richiedere le varie proiezioni: standard, ascellare, intra ed extrarotazione; il reperto radiologico può non evidenziare niente fino a 5 anni dopo l'esordio dei sintomi (Fase 0-1). Nella fase 2, i primi segni radiologici sono caratterizzati da una sottile sclerosi a forma di cuneo, l’osso appare chiazzato e può essere presente una diffusa area di osteopenia mentre la sfericità della testa omerale è conservata. Nella fase 3 mostra un segno di mezzaluna o frattura/collasso (appiattimento della testa femorale) con minima depressione della superficie articolare. Infine, nella fase 4, vi è un appiattimento della superficie articolare e dell'osso subcondrale con frammentazione e corpi liberi endoarticolari e artrite secondaria. Nella fase 4, per finire, si stabilisce il restringimento dello spazio articolare con alterazioni di tipo osteoartrosico a carico delle ossa prospicienti l’articolazione. La fase 5 o stadio terminale la NAV si manifesta con un crollo avanzato della testa omerale associato ad alterazioni degenerative della glena (artrite).
- Scintigrafia – pur essendo più sensibile dei raggi-x non è specifica ed è usata meno spesso della RMN; per tale motivo non è più consigliata per l'individuazione e la diagnosi di osteonecrosi eccetto nei casi ove c’è il sospetto di infezione (scintigrafia ai leucociti marcati). I motivi sono dovuti ad esperienze fatte che dimostrano come solo in un terzo dei casi ha identificato la malattia in casi sicuramente certi.
- RM – è la modalità più sensibile e specifica (~ 90-100%) ed è l’unica che mostra i segni precoci della malattia; dovrebbe essere usata per la diagnosi molto precoce; può manifestarsi con segni di edema diffuso subcondrale della testa omerale. Successivamente una focale linea serpiginosa di segnale basso con una zona centrale di grasso. Quando evidenzia una doppia linea di frammentazione subcondrale è specifica per la diagnosi.
- Istologia – è il mezzo diagnostico più specifico ma non da utilizzare nella diagnosi precoce per la sua invasività. Molto utile nei casi dubbi.
Terapia
Un principio comune a tutte le patologie cioè quello della prevenzione può essere applicato anche in questo caso. I controlli dovrebbero essere effettuati in tutti i pazienti a rischio (vedi Tab. 1). La terapia va stabilita sulla scorta della stadiazione della malattia poiché ad ogni stadio corrisponde una terapia specifica.
Uno studio ha studiato 200 spalle con NAV ed ha rilevato che circa il 40% di diagnosi precoce erano poi progredite in fase avanzata e di questi il 55-80% erano, poi, ancora peggiorati nel percorso della malattia.
- Trattamento conservativo – è limitato solo nelle fasi iniziali; il trattamento farmacologico serve per ripristinare l’apporto di sangue e consentire una nuova crescita ossea. I farmaci generalmente utilizzati includono agenti ipolipemizzanti (controllo della colesterolemia), vasodilatatori, anticoagulanti e terapie per prevenire la perdita di tessuto osseo. Uno specifico farmaco da utilizzare è direttamente dipendente dalla malattia sistemica di base che causa il problema delle ossa. E’ importante, inoltre: a)mantenere la funzione articolare della spalla sia della forza muscolare sia del ROM (range of motion) b)bloccare la progressione della malattia c)controllare la sintomatologia dolorosa mediante l’utilizzo di FANS che però non sono utili a rallentare o fermare l'osteonecrosi d)educare il paziente soprattutto per quanto riguarda i fattori di rischio (consumo di alcool, uso di tabacco, uso dei corticosteroidi, ecc.) non escludendo anche un miglior governo dell’ attività fisica. Mancano ancora sufficienti dati a sostegno della terapia extracorporea con onde d’urto.
- Trattamento chirurgico – in uno stadio iniziale, quando ancora non è collassata la superficie articolare, può essere utile la decompressione della testa omerale (Fig. 4a); tale indicazione chirurgica sta nel fatto che si ritiene che la perdita del flusso ematico nella testa omerale stabilisce un aumento della pressione nell’osso; la metodica determina un sollievo del dolore e stimola un miglior afflusso di sangue favorendo la guarigione. Gli stadi migliori da trattare sono il I e II con incertezza sul III. Infatti le percentuali di guarigione sono del 40-90% (Mont-La Porte). Una tecnica che si è sviluppata molto negli ultimi anni è quella artroscopica (Fig.4b); con tale metodica, infatti, il chirurgo può effettuarela rimozionedi tessuti necrotici ed eventuali residui presenti in articolazione ma anche la levigazione della superficie articolare; infine può essere associata alla decompressione e guidare meglio tale tecnica; non è consigliata negli stadi tardivi della malattia.
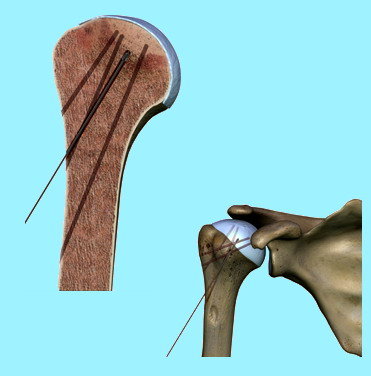
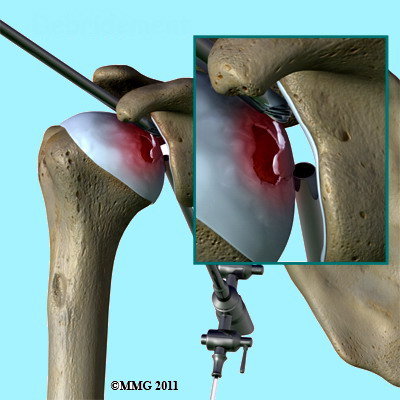
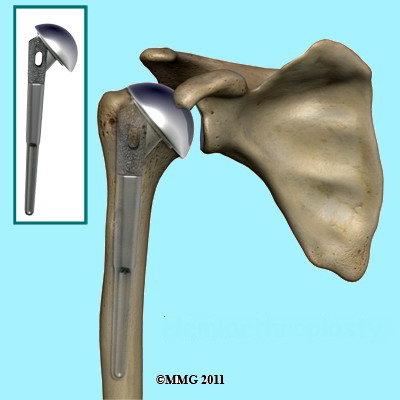
Fig. 4 a - b - c
Quando la superficie articolare si è collassata o frammentata, come negli stadi III-IV e V si pone indicazione ad un intervento di artroplastica (5% dei casi) (Fig.4c). Tale intervento rappresenta una scelta affidabile quando si vuole ripristinare tutto il ROM e fornire sollievo dal dolore; in letteratura è riportata una riduzione del dolore pari al 90-100% . Non vi sono dati certi per quanto riguarda i risultati tra la Emiartroprotesi e la Protesi Totale poiché in letteratura vi sono ancora molto controversie se si eccettua lo stadio V allorquando è coinvolta anche la glena scapolare.
L’ Emiartroprotesi è anche definita protesi parziale poiché viene sostituita solo una parte dell’articolazione ed esattamente la componente omerale mentre la Protesi Totale prevede la sostituzione anche della glena della scapola. Ultimamente, però, stanno crescendo i consensi verso l’utilizzo di una procedura meno invasiva chiamata Protesi di Superficie. E’ questa una protesi che non prevede l’asportazione della testa omerale bensì viene mantenuta e “ricoperta” da una sorta di tappo metallico con un fittone stabilizzante nell’osso. Tale metodica prevede che l’osso sia abbastanza buono.
Bibliografia
- Blanche P, Si-Larbi AG, Jouve P. Femoral head necrosis and hyperhomocysteinemia. J Rheumatol 2001; 28: 1469.
- CruessRL: Experience with steroid-induced avascularnecrosisof the shoulder and etiologic considerations regarding osteonecrosis of the hip. Clin Orthop Relat Res 1978; 130:86-93
- CruessRL: Corticosteroid-induced osteonecrosis of the humeralhead. Orthop Clin North Am 1985; 16:789-796.
- Darlington LG. Osteonecrosis at multiple sites in a patient with systemic lupus erytematosus. Ann RheumDis 1985; 44:65-6.
- Dawson SJ, Wiman B, Hamsten A, Green F, Humphries S, Henney AM. The two allele sequences of a common polymorphism in the promoter of the plasminogen activator inhibitor-1 (PAI-1) gene respond differently to interleukin-1 in HepG2 cells. J Biol Chem 1993; 268: 10739-45.
- Elmsted E, Svahn T. Skeletal complicatios following renal transplantation. Acta Orthop Scand 1981; 52: 279- 86.
- Feeley BT, Fealy S, Dines DM, Warren RF, Craig EV. Hemiarthroplasty and total shoulder arthroplasty for avascular necrosis of the humeral head. J Shoulder Elbow Surg 2008;17(5): 689-694.
- Felix C, Blatt J, Goodman MA, Medina J. Avascular necrosis of bone following combination chemotherapy for acute lymphocytic leukaemia. Med Pediatr Oncol 1985; 13: 269-72.
- Felson DT, Anderson JJ. Across-study evaluation of association between steroid dose and bolus steroids and avascular necrosis of bone. Lancet 1987; 1: 902-6.
- Ferrari P, Schroeder V, Anderson S, Kocovic L, Vogt B, Schiesser D, et al. Association of plasminogen activator inhibitor-1 genotype with avascular osteonecrosis in steroid-treated renal allograft recipients. Transplantation 2002; 74: 1147-52.
- Ficat RP, Arlet J. Functional investigation of bone under normal conditions. In: Hungenford DS, editor. Ischemia and necrosis of bone. Baltimore: Williams and Wilkins, 1980; 29-52.
- Frankel ES, Urbaniak JR. Osteonecrosis. In: Ruddy S,Harris ED, Sledge CB, editors. Kelley’s Textbook of Rheumatology, 6th ed. W.B. Saunders Company, 2001; 1653-65.
- Glueck CJ, Fontaine RN, Gruppo R, Stroop D, Sieve- Smith L, Tracy T, et al. The plasminogen activator inhibitor- 1 gene, hypofibrinolysis, and osteonecrosis. Clin Orthop 1999; 366: 133-46.
- Glueck CJ, Freiberg R, Tracy T, Stroop D, Wang P. Thrombophilia and hypofibrinolysis. Clin Orthop 1997; 334: 43-56.
- Glueck CJ, Freiberg R, Gruppo R. Thrombophilia and hypofibrinolysis: reversible pathogenetic etiologies of osteonecrosis in adults and in children (Legg-Perthes disease). In: Urbaniak JR, Jones Jr JP, editors. Osteonecrosis: etiology, diagnosis and treatment. Rosemont IL, American Academy of Orthopaedic Surgeons, 1997: 105-10.
- Hasan S, Romeo A: Nontraumatic osteonecrosis of the humeral head J Shoulder Elbow Surg 2008; 281-298
- HattrupSJ, CofieldRH Osteonecrosis of the humeral head: Relationship of disease stage, extent, and cause to natural history. J Shoulder Elbow Surg 1999; 8:559-564.
- Harreld KL, Marker DR, Wiesler ER, Shafiq B, Mont M. Osteonecrosis of the Humeral Head. J Am Academy of Orthop Surgeons 2009;17(6): 345-355.
- Kubo T, Yamazoe S, Sugano N, Fujioka M, Naruse S, Yoshimura N, et al. Initial MRI findings of non-traumatic osteonecrosis of the femoral head in renal allograft recipients. Magn Reson Imaging 1997; 15: 1017- 23.
- Kubo T, Tsuji H, Yamamoto T, Nakahara H, Nakagawa M, Hirasawa Y. Antithrombin III deficiency in a patient with multifocal osteonecrosis. Clin Orthoped Rel Res 2000; 378: 306-11.
- Jones DN. Multifocal osteonecrosis following chemotherapy and short-term corticosteroid therapy in a patient with small cell bronchogenic carcinoma. J Nucl Med 1994; 35: 1347-50.
- Jones LC, Mont MA, Le TB, Petri M, Hungerford DS, Wang P, et al. Procoagulants and osteonecrosis. J Rheumatol 2003; 30: 783-91.
- La Porte DM, Mont MA, Mohan V, Jones LC, Hungerford DS. Multifocal osteonecrosis. J Rheumatol 1998; 25: 1968-74.
- Mont MA. Symptomatic multifocal osteonecrosis. A multicenter study. Clin Orthop Rel Res 1999; 369: 312- 26.
- Mont MA, Payman RK, Laporte DM, Petri M, Jones LC, Hungerford DS: Atraumatic osteonecrosis of the humeral head. J Rheumatol 2000; 27:1766-1773
- Mont MA, Hungerford DS. Osteonecrosis of the shoulder, knee and ancke. In: Urbaniak JR, Jones Jr JP eitors. Osteonecrosis: etiology, diagnosis and treatment. Rosemont, IL, American Academy of Orthopaedic Surgeons 1997; 429-36.
- Pierre-Jacques H, Glueck CJ, Mont MA, Hungerford DS. Familial heterozygous protein S-deficiency in a patient with multifocal ostenecrosis. J Bone Joint Surg 1997; 79A: 1079-84Sartori MT, Wiman B, Vettore S, Dazzi F, Girolami A, Patrassi GM. 4G/5G polymorphism of PAI-1 gene promoter and fibrinolytic capacity in patients with deep vein thrombosis. Thromb Haemost 1998; 80: 956-60.
- Sartori MT, Vettor R, De Pergola G, De Mitrio V, Saggiorato G, Della Mea P, et al. Role of the 4G/5G polymorphism of PaI-1 gene promoter on PaI-1 levels in obese patients: influence of fat distribution and insulinresistance. Thromb Haemost 2001; 86: 1161-9.
- Sartori MT, Patrassi GM, Rigotti P, Marchini F, Fioretti M, Spiezia L, et al. Improved fibrinolytic capacity following withdrawal of steroid immunosuppression in renal transplant recipients. Transplantation 2000; 69:2116-21.