
Cos'è la diarrea? Gastroenterite, tossinfezione alimentare, diarrea da farmaci o emotiva: tutte le cause infettive e non infettive e i possibili rimedi.

Iperacusia e stress lavoro-correlato: inquadramento clinico, implicazioni psicologiche e protocollo
![]() Dr.ssa Eleonora Riva
Dr.ssa Eleonora Riva
28.12.2025 - L’iperacusia riduce la tolleranza ai suoni e può incidere su stress lavoro-correlato e qualità di vita. Scopri cause, impatto e interventi integrati.

Avvicinare il medico e il paziente abbattendo le barriere socio culturali.

Aumentare la consapevolezza rispetto alle scelte sulla propria salute.

Promuovere la cultura medica per evitare l'autodiagnosi e l'autocura.
Oltre 497.2k utenti registrati si fidano di noi.
Gli Specialisti della Community, verificati alla registrazione, collaborano gratuitamente per offrire contenuti medico-scientifici accurati, veritieri e aggiornati.
I Referenti Scientifici, garanti delle Linee Guida, vigilano quotidianamente sulla qualità dei contenuti pubblicati.

Dr. Paolo Piana Urologo

Dr.ssa Anna Potenza Psicologo

Dr. Antonio Ferraloro Neurologo

Dr. Matteo Pacini Psichiatra

Dr. Vincenzo Capretto Psicologo

Dr. Edoardo Bernkopf Dentista

Dr. Vincenzo Della Corte Neurochirurgo

Dr. Salvo Catania Oncologo
Oggi già 4 risposte dai nostri medici specialisti!
Consulta l'archivio
Tra più di 1.6 milioni di consulti trova la situazione simile alla tua.
Hai un disturbo di salute?
Descrivi il tuo problema e chiedi un consulto ai nostri specialisti.
Sei uno specialista?
Aiuta gli utenti in difficoltà e rispondi ai loro dubbi.

Cos'è la diarrea? Gastroenterite, tossinfezione alimentare, diarrea da farmaci o emotiva: tutte le cause infettive e non infettive e i possibili rimedi.

FSH alto e 17 beta-estradiolo basso: sono in menopausa?
Dr.ssa De Falco
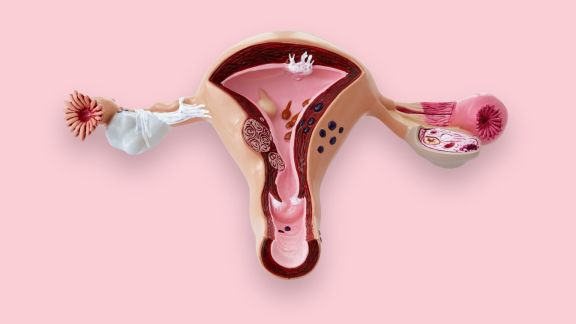
Ectopia o ectropion? Le piaghette sul collo dell'utero
Dr.ssa De Falco

Le fratture del piatto tibiale
Dr. Preite
Dr. Bacosi

Come si calcola
il rischio reale di tumore al seno
Storie di ragazze fuori di seno
Il primo blog di Medicina Narrativa
2.971 utenti che hanno scritto 828.194 commenti, 55.213 pagine di contenuti equivalenti nel cartaceo a 1497 volumi da 225 pagine, con oltre 600.000 visualizzazioni mensili e 36.373.868 visualizzazioni totali
Acidità, stress e febbre con inibitori di pompa: alternative?
Salve a tutti, storicamente ho sempre avuto sensibilità e tendenza all'eccessiva acidità gastrica, fin da piccolo. La cosa è più o meno gestibile in base al cibo e ai periodi di stress più o...
Buonasera, ho fatto visita PS in quanto il misura pressione segnalava sempre aritmia. Da ECG risulta ritmo sinusale normale e Qt/Qtc-baz 352/449 ms. Mi hanno consigliato di fare holter cardiaco...
Spaccature al prepuzio dopo rapporti: possibili cause e soluzioni?
Salve a tutti l’anno scorso sono stato operato per la seconda volta per circoncisione, la prima andata male poiché la cicatrizzazione del prepuzio risultava oscena a vedersi decidendo così di...
Buonasera, sono stata operata un anno fa di ernia femorale e rimozione di 3 linfonodi perché più grandi del normale...ho dolore nel camminare e stare seduta, anche dopo vari sforzi...il dolore è...