Colon irritabile o sindrome dell’intestino irritabile: quali le cause e come fare la diagnosi
La Sindrome dell'intestino o colon irritabile (IBS, Irritable Bowel Syndrome) è il disturbo gastrointestinale funzionale più studiato, caratterizzato da sintomi caratteristici, come dolore addominale ricorrente o disagio addominale, in associazione con stitichezza o diarrea. Colpisce in genere gli adulti di età compresa tra i 30 ed i 50 anni circa, con predominanza nel sesso femminile. È un disturbo difficile da diagnosticare e, ad oggi, non vi sono cure specifiche, ma solo strategie di trattamento “su misura”, improntate al controllo dei sintomi ed al miglioramento della qualità della vita nello specifico paziente.
Indice
Cos'è la sindrome dell'intestino irritabile?
La sindrome dell'intestino irritabile (IBS, Irritable Bowel Syndrome), o colon irritabile, rappresenta una delle diagnosi più comuni effettuate in ambito gastroenterologico. Nonostante questo, le cause dell'IBS sono poco conosciute.
La Sindrome dell'intestino irritabile (IBS)1
Nel passato, questo disturbo "funzionale" gastrointestinale è stato definito con terminologie varie: Osler, nel 1892, coniò il termine di colite mucosa, con il quale intendeva definire un disturbo contraddistinto da mucorrea e coliche addominali che colpiva, con una incidenza elevata, pazienti affetti da comorbidità in ambito psicopatologico.
In Italia la sindrome dell'intestino irritabile viene spesso indicata con terminologia non corretta: è stata descritta con i termini più disparati e diversi, talora anche di estrazione popolare, tra cui ricordiamo colon spastico, colon nervoso, colon irritato, colite, colite nervosa, colon infiammato, colite spastica, colon irritabile.
Quali disturbi provoca il colon irritabile?
In questa sindrome non è, ad oggi, evidente alcun danno organico. Si tratta, pertanto, di una anomalia funzionale del colon, contraddistinta da caratteristici disturbi che vanno dal meteroismo e pancia gonfia alla anomala defecazione, con predominanza di stitichezza o di diarrea o con loro alternanza.
L’IBS è difficile da diagnosticare oltre che da curare, poiché non esiste una terapia specifica: ha un impatto notevole sulla qualità della vita dei pazienti che ne sono affetti, e non sembra essere associata con lo sviluppo di malattie gravi o con un aumento di mortalità.
Attualmente, le strategie terapeutiche si concentrano sul controllo dei sintomi e sul miglioramento della qualità della vita dei pazienti.
La terapia farmacologica comprende varie tipologie di prodotti (ad es. antidiarroici, lassativi, antispastici, procinetici, antidepressivi, antibiotici) a cui vengono spesso associate misure dietetiche, utilizzo di probiotici, rimedi naturali, esercizio fisico, psicoterapia, oltre che metodiche alternative (CAM, Complementary and Alternative Medicine).
Diffusione nella popolazione
La sindrome dell'intestino irritabile colpisce una percentuale variabile tra il 10% ed il 20% della popolazione (sia adulti che adolescenti), sia in Europa che negli Stati Uniti.
Gli studi epidemiologici dimostrano una prevalenza relativamente bassa nel Nord Europa (Danimarca e Olanda), con una percentuale che oscilla tra il 5 ed il 15%, mentre è più diffusa negli altri paesi europei con un picco proprio in Italia dove può colpire sino al 30% della popolazione. Le popolazioni di Asia ed Africa hanno una minore prevalenza di sindrome dell'intestino irritabile. Non è ben chiaro se possono avere un ruolo le diverse influenze, sociali, culturali e sanitarie.

Incidenza dell'IBS
Il picco della prevalenza è tra i 20 e i 30 anni, invece la fascia di età che più frequentemente decide di ricorrere alle cure mediche è compresa tra i 30 e i 50 anni. Il colon irritabile colpisce maggiormente le donne rispetto agli uomini, secondo un rapporto di 2:1; nel subcontinente indiano, invece, i maschi rappresentano il 70-80 % dei pazienti con IBS. Sono soprattutto le donne a decidere di rivolgersi da un medico per la cura dei loro disturbi. I pazienti spesso si accorgono in modo retrospettivo del fatto che il dolore addominale e le alterate abitudini intestinali erano sintomi presenti già durante l'infanzia.
La ricorrenza dei sintomi nel breve periodo (da alcune settimane ad alcuni mesi) è più frequente, mentre, nel corso di un periodo di tempo più lungo (in genere di anni), i sintomi, caratteristicamente, presentano periodi di remissione e periodi di riacutizzazione.
Inoltre, sebbene la maggioranza delle persone con IBS non consultino i medici o gli specialisti, i costi per la società in termini di spese sanitarie (visite specialistiche in gastroenterologia, indagini diagnostiche non necessarie, ricoveri ospedalieri ed interventi chirurgici) e di costi indiretti (come l’assenteismo dal lavoro) sono davvero considerevoli.
Cause
I complessi meccanismi che portano alla sindrome del colon irritabile non sono ancora ben chiari e quindi ancora oggetto di ricerca.
È possibile riassumere alcuni meccanismi fisiopatogenetici, per i quali non è stato ancora dimostrato un elemento unificante:
- alterata motilità gastrointestinale
- iperalgesia viscerale
- infiammazione microscopica
- fattori genetici
- psicopatologia
- la teoria del secondo cervello.
Cause del colon irritabile 2
Alterata motilità gastrointestinale
Questo meccanismo prevede un'alterazione della funzione motoria, sia del piccolo che del grande intestino.
Nell'intestino esiste un modello ciclico di motilità noto come Complesso Motorio Migrante (MMC, Migrating Motor Complex), composto da contrazioni periodiche che spingono il contenuto intestinale dallo stomaco all'ileo terminale.
Nei pazienti con IBS vi sarebbero anomalie di questo meccanismo motorio, con una maggiore frequenza delle contrazioni ed una maggiore motilità preprandiale del colon; ciò potrebbe spiegare anche l'iperalgesia viscerale in questi pazienti.
L'attività muscolare del colon, tesa a far procedere le feci sino alla completa evacuazione, prevede un’attività basale composta da onde lente di contrazione, con una sovrapposizione di contrazioni più energiche, soprattutto in fase post-prandiale. Nel colon irritabile la dismotilità altera la frequenza contrattile del tono basale ed i tempi della risposta contrattile post-prandiale.
I pazienti inclini a diarrea presentano questa dismotilità in misura maggiore rispetto ai pazienti inclini alla costipazione. Anche il piccolo intestino manifesta dismotilità, con ritardato transito nei pazienti IBS-C e accelerato transito nei pazienti IBS-D; questi pazienti, inoltre, mostrano intervalli più brevi tra onde successive di propulsione (onde predominanti interdigestive del piccolo intestino).
Le attuali teorie integrano queste dismotilità diffuse, ipotizzando una iperreattività generalizzata della muscolatura liscia; ciò spiegherebbe anche la presenza di sintomi urinari, tra cui ricordiamo l’aumento della frequenza minzionale, l'urgenza minzionale e la nicturia.
Iperalgesia viscerale
L'IBS è caratterizzata da un'anormale percezione della fisiologica motilità intestinale e da una sensibilità spiccata al dolore viscerale. I pazienti con la sindrome del colon irritabile riferiscono il dolore secondo distribuzioni dermatomeriche (diffusione di riferimento cutaneo) più ampie rispetto al dolore viscerale percepito, ovvero il dolore proveniente da un segmento colico (es. sigma) può essere percepito in un’area addominale più vasta.
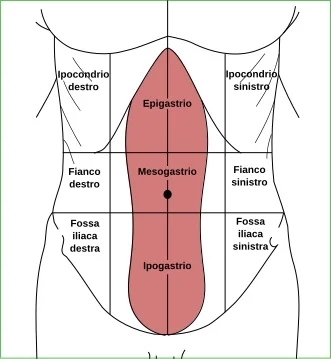
Quadranti addominali 3
Infiammazione microscopica
In passato si riteneva che la sindrome dell'intestino irritabile non fosse caratterizzata da una flogosi (infiammazione) istologicamente dimostrabile. In realtà si è visto che alcuni pazienti, in precedenza affetti da enteriti infettive, manifestano, successivamente, una IBS post-infettiva; anche la microflora fecale subisce delle alterazioni.
I pazienti con IBS post-infettiva dimostrano aumento intramucosale di linfociti (linfocitosi colica) ed iperplasia delle cellule enteroendocrine (secernenti sostanze, come la serotonina, che agiscono sulla motilità, sulla vascolarizzazione e sulla risposta immunitaria del colon).
Queste cellule, nella IBS post-infettiva, possono secernere elevati livelli di serotonina, con aumento della secrezione colica e possibile insorgenza di IBS-D. L'infezione da Giardia Lamblia ha dimostrato di portare ad un aumento della prevalenza di IBS post-infettiva; uno studio su pazienti con Giardiasi ha rilevato come la prevalenza della sindrome dell'intestino irritabile sia stata del 46,1% fino a tre anni dopo l’avvenuta infezione, rispetto al 14% riscontrato nei controlli.
Fattori Genetici
I progressi della genetica e della genomica, compiuti nell’ambito delle malattie digestive, lasciano ipotizzare una base genetica anche per la sindrome dell'intestino irritabile. Alcuni lavori evidenziano che i parenti di un individuo con IBS hanno più probabilità (da due a tre volte) di essere affetti da IBS rispetto alla popolazione standard.
È stato osservato che gemelli eterozigoti manifestano entrambi l'IBS in circa l'8,4% dei casi, mentre gli omozigoti in circa il 17,2%. Ad oggi però occorrono ancora ulteriore conferme scientifiche sui fattori genetici; sono pertanto necessari studi clinici sulle interazioni genetico-ambientali da realizzare su campioni di popolazione più ampi.
Psicopatologia
La comorbidità psicologica e psichiatrica è comune nei soggetti con IBS, ma le associazioni tra disturbi psichiatrici e sindrome dell'intestino irritabile non sono state ancora definite, né accertate, con sufficiente chiarezza, come anche non è chiaro se i disturbi psicopatologici siano all’origine della IBS o viceversa.
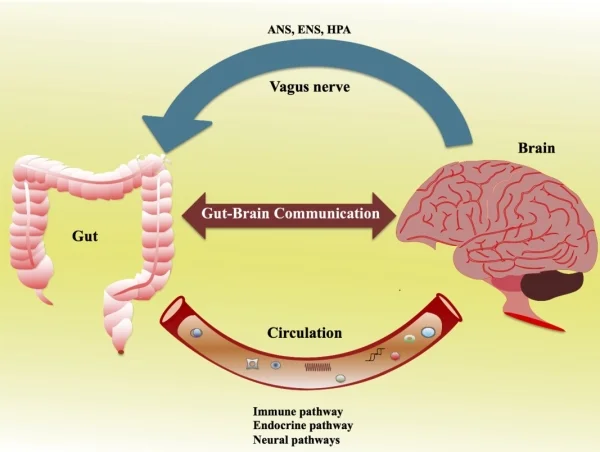
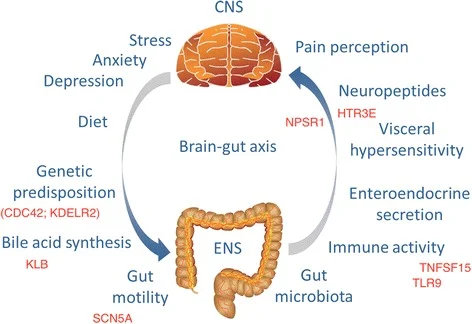
È certo, però, che l’alterazione dell’Asse Cervello-Intestino (Brain-Gut Axis) fa si che si possa rilevare l’insorgenza di sintomi gastrointestinali in circa il 77% dei pazienti. Si pensa a vari meccanismi neuro-ormonali centrali come anche ad anomalie del sistema limbico, queste ultime dimostrate attraverso studi con PET (tomografia ad emissione di positroni) condotti su pazienti con IBS e su pazinti affetti da depressione maggiore. L'asse ipotalamo-ipofisario potrebbe avere un ruolo nei disturbi della motilità, a causa dell’aumentata produzione ipotalamica del fattore di rilascio della corticotropina (CRF) in risposta allo stress.
Brain-Gut-Axis-Microbiota 5
La teoria del secondo cervello
Michael D. Gershon, un neurobiologo, esperto di anatomia e biologia cellulare presso la Columbia University, ha elaborato la "teoria dei due cervelli", secondo la quale l’uomo sarebbe dotato di due cervelli: i
- il primo, il Sistema Nervoso Centrale (Central Neurons System, CNS), situato nella testa;
- il secondo, il Sistema Nervoso Enterico (Enteric Nervous System, ENS), nella cavità addominale.
L'ENS o SNE (Sistema Nervoso Enterico) sarebbe costituito da una ricca rete neuronale, circa 100 milioni di neuroni (numero paragonabile a quelli che costituiscono il midollo spinale), ben strutturata nell’intestino, con un alto grado di autonomia dal CNS o SNC (Sistema Nervoso Centrale).
Entrambi i cervelli (CNS e ENS) producono neurotrasmettitori come la serotonina, la dopamina, l’acetilcolina e altri specifici neuro-ormoni come la grelina, oltre a sostanze psicoattive. Stimoli esterni, recepiti dal sistema nervoso centrale, possono provocare un'azione di eccessivo stimolo alla produzione di serotonina o, al contrario, bloccarne l'azione; ne conseguirà un transito accelerato nel colon (diarrea) o rallentato (stipsi).
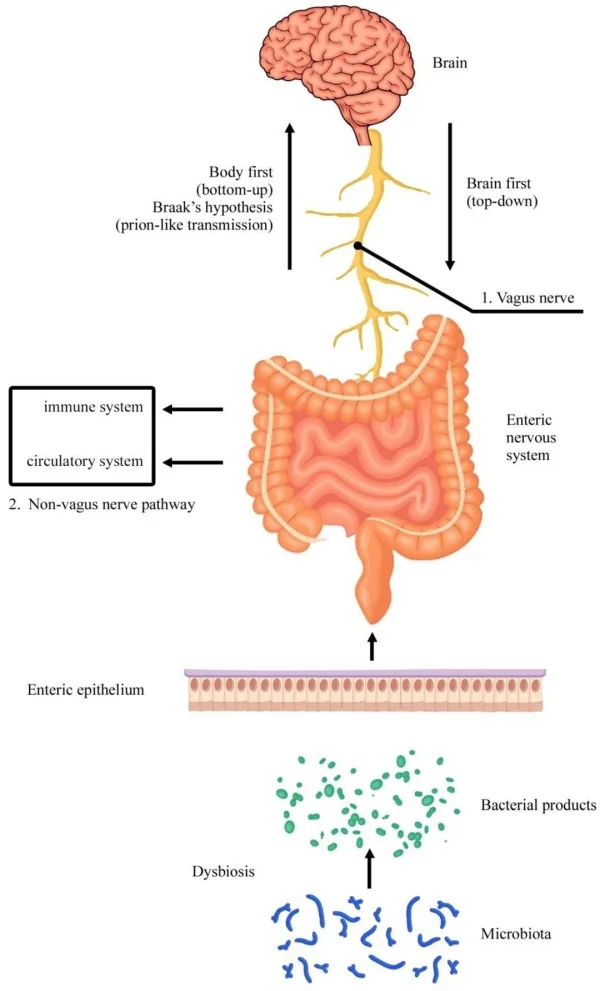
La teoria dei due cervelli 6
Secondo questa teoria i due cervelli si interconnettono strettamente, tramite una ricca rete di fibre nervose, il GUT-BRAIN AXIS (lett. "asse cervello-intestino"), secondo un sistema di relazioni bidirezionale. Pertanto il primo cervello può alterare il normale funzionamento del secondo, interferendo con i suoi ritmi (peristalsi, produzione di acidi, di enzimi, di ormoni, di citochine), ma può accadere anche il contrario.
Dieta e disordini intestinali sono collegati a variazioni dell'umore, mantre, nell’altro senso, stress e ansia pesano sull'intestino e ne alterano il funzionamento. Si pensi che oltre l'80% della serotonina, chiamata anche "neurotrasmettitore del benessere", viene prodotta proprio dal secondo cervello.
Sintomi
Vediamo quali possono essere i diversi sintomi della sindrome del colon irritabile.
Alterazioni dell’alvo
- Può prevalere la stipsi (costipazione), con emissione di feci dure e sottili, defecazione poco frequente e dolorosa, poco sensibile al trattamento con lassativi.
- Può prevalere la diarrea, di solito descritta come emissione di piccole quantità di feci molli, il paziente lamenta una evacuazione preceduta da urgenza defecatoria e da frequenti stimoli evacuativi.
- Anche l’urgenza defecatoria postprandiale è di comune riscontro, insieme all’alternanza tra stipsi e diarrea.
- Al di là di questi quadri prevalenti e predominanti nel singolo paziente, può esservi anche una significativa variabilità.
Dolore addominale
Questo sintomo doloroso si può presentare in vari modi, può essere:
- Diffuso, senza irradiazioni.
- Comunemente si localizza nel basso ventre ed in particolare nel quadrante addominale inferiore sinistro.
- Il paziente descrive episodi di dolore particolarmente acuto, che può sovrapporsi ad un dolore sordo, già presente e più costante.
- I pasti possono acuire le crisi dolorose.
- La defecazione, in genere, attenua ma non allevia pienamente il dolore.
- Il dolore, legato a sacche di gas localizzate nel colon a livello della flessura splenica, può manifestarsi come un dolore toracico oppure un come un dolore addominale del quadrante superiore sinistro.
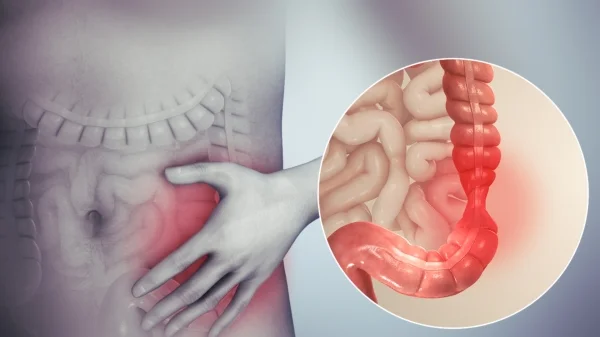
Spasmi colici 7
Distensione addominale
I frequenti sintomi di gonfiore e distensione gassosa, nei pazienti con sindrome dell'intestino irritabile, potrebbero essere legati ad un eccessiva proliferazione batterica (S.I.B.O., Small-Bowel Bacterial Overgrowth), denominata Sindrome da Contaminazione Batterica del Tenue.
Potrebbero avere un ruolo i FODMAPs (Fermentable Oligosaccharides, Disaccharides, Monosaccharides and Polyols) ovvero "Oligosaccaridi, Disaccaridi, Monosaccaridi Fermentabili e Polioli". I saccaridi (fruttosio, lattosio, fruttano e galattano) ed i polioli (sorbitolo, mannitolo, xilitolo e maltitolo).
Si tratta di carboidrati a catena corta, assorbiti in modo incompleto nel tratto gastroIntestinale che possono, quindi, indurre stati di fermentazione nell’intestino, determinando:
- irritazione,
- gas,
- gonfiore addominale,
- diarrea e costipazione.
Si è visto che una dieta a basso contenuto di FODMAPs migliora la sintomatologia dei pazienti affetti da IBS.
Per approfondire:Pancia gonfia? La dieta FODMAPs
Altri sintomi
- Mucorrea su base non infiammatoria, con emissione di muco chiaro, talora biancastro.
- Dispepsia, bruciore di stomaco.
- Nausea, vomito.
- Disfunzioni sessuali, tra cui la dispareunia (dolore durante l’atto sessuale) e il calo della libido.
- Minzione frequente e urgenza minzionale.
- Peggioramento dei sintomi nel periodo premestruale.
- Fibromialgia, ovvero uno stato generalizzato di dolenzia (algia) delle strutture fibrose (tendini e legamenti) e dei muscoli.
- Sintomi stress-correlati.
Sintomi e riscontri NON COERENTI con la Sindrome dell'Intestino Irritabile
Vi possono essere, accanto ai sintomi descritti, alcuni sintomi ed elementi di riscontro addizionali che, quando presenti, devono indurre il clinico a ritenere possibile una patologia organica.
Gli elementi da considerare sono i seguenti:
- L'esordio dopo i 50 anni.
- L’esordio acuto ed improvviso dei sintomi (la sindrome dell'intestino irritabile è invece contraddistinta dalla cronicità dei sintomi).
- L’evoluzione progressivamente crescente dei sintomi.
- Un dolore e/o una diarrea che comportano il risveglio del paziente, ovvero che interferiscono con il sonno.
- L’Anoressia e/o la perdita di peso.
- La febbre.
- Il sanguinamento rettale.
- La diarrea indolore.
- La steatorrea (evacuazione di feci contraddistinte da una grande quantità di grassi non digeriti),
- Il legame dei sintomi con l’assunzione di lattosio o glutine.
- Storia familiare di malattie organiche gastrointestinali (ad es. IBD, Morbo Celiaco, Cancro del Colon-Retto).
Classificazione
Da sempre si è cercato di adottare una classificazione condivisa dei disordini funzionali gastrointestinali (FGIDs, Functional GastroIntestinal Disorders).
Il primo tentativo sistematico di caratterizzare l’IBS (allora chiamata "sindrome del colon irritabile " o ICS) è stato fatto da Chaudhary e Truelove (Oxford, Inghilterra) nel 1962. Nel 1978 furono elaborati i "Criteri di Manning" per la sindrome dell'intestino irritabile; dopo questa prima ed importante classificazione, il lavoro scientifico è proseguito con ulteriori studi.
Attualmente i criteri diagnostici seguiti nel campo delle FGIDs sono i “Criteri di Roma”, ovvero una serie di criteri, stabiliti da una commissione internazionale, per definire la diagnosi ed orientare il trattamento dei disordini funzionali gastrointestinali, tra i quali è ricompresa la sindrome dell'intestino irritabile (IBS). Questi criteri diagnostici sono nati grazie alla Fondazione Roma, organizzazione no-profit, sotto la gestione professionale della Degnon Associates con sede a McLean, in Virginia (USA).
I criteri di Roma furono definiti, per la prima volta, durante il "XIII International Congress of Gastroenterology and the VI European Congress of Digestive Endoscopy" tenutosi a Roma il 09 settembre 1988, e successivamente rielaborati nell'arco di quattro anni. Il lavoro è stato pubblicato nel 1992 (Criteri di Roma I) con una prima rivisitazione avvenuta nel 1999 (Criteri di Roma II) ed una terza revisione realizzata nel 2006 (Criteri di Roma III) durante il DDW (Digestive Diseases Week) tenutosi a Los Angeles (USA). I criteri sono il frutto del lavoro che vede impegnati, nella Fondazione Roma, numerosi (oltre 100) ricercatori internazionali, esperti in FGIDs.
La specificità dei Criteri di Roma supera il 98%, quindi il rischio di misconoscere una patologia organica è molto basso.
Il requisito cardine per la diagnosi di IBS è il dolore addominale.
Criteri di Manning
| Criteri di Manning (1978) |
|
Criteri di Roma
| Criteri di Roma I (1992) |
| Il dolore o il discomfort addominale devono essere presenti, continuativamente, da almeno tre mesi, con almeno 1 dei seguenti riscontri associati:
e con almeno 2 o più dei seguenti riscontri, associati almeno nel 25% delle evacuazioni:
Altri sintomi eventualmente associati:
|
| Criteri di Roma II (1999) |
| Per poter porre diagnosi di IBS occorre che il dolore o il discomfort addominale debbano essere stati presenti per almeno 12 settimane (non necessariamente consecutive), o più, negli ultimi 12 mesi; inoltre devono essere necessariamente accompagnarsi ad almeno due dei seguenti sintomi:
Gli altri sintomi suggestivi (alterata frequenza/consistenza delle feci, alterato passaggio delle feci, presenza di muco, gonfiore o tensione addominale) possono essere presenti, ma non sono elementi sintomatologici fondamentali. |
| Criteri di Roma III (2006) |
Il dolore e/o il discomfort addominale devono ricorrere per 3 gg/mese negli ultimi 3 mesi, con insorgenza dei sintomi da oltre 6 mesi, o più, prima della diagnosi, associati con almeno 2 dei seguenti riscontri:
Possono esservi sintomi suggestivi aggiuntivi:
Alcune note: Per Discomfort si intende una sensazione di disagio non descritto come dolore. |
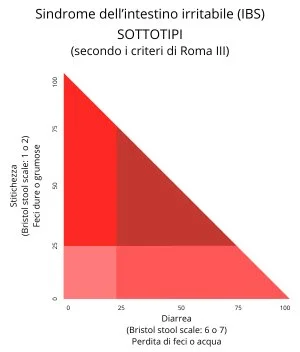
Sottotipi della sindrome da intestino irritabile
Il comitato di Roma II tentò di sottoclassificare l’IBS sulla base di numerosi criteri (frequenza dell’evacuazione, forma delle feci, sintomi defecatori), ma una tale complessità classificativa, sommata alla mancanza di un approccio evidence-based (basato sull’evidenza), ha fatto si che la sottoclassificazione venisse rivista, basandola esclusivamente sulla consistenza delle feci.
Con i Criteri di Roma III è stata validata la Bristol Stool Scale, quale utile e facile strumento, sia per la diagnosi di IBS, nelle sue varianti cliniche, che per una valutazione della risposta ai vari trattamenti terapeutici. La sottoclassificazione di IBS è importante perché consente di differenziare anche le diverse scelte di trattamento ed i meccanismi fisiopatologici che sottendono le varie sottoclassi. La nuova proposta di classificazione prevede 4 sottocategorie di IBS in base al carattere prevalente delle feci.
| Classificazione (Functional bowel disorders - Longstreth G.F. et al. - Gastroenterology. 2006 Apr;130(5):1480-91) | ||
|
| CLASSE | CARATTERISTICHE delle FECI |
| IBS-C, costipazione predominante | feci dure o bozzolute in ≥ 25% e feci sfatte o acquose in < 25% delle defecazioni | |
| IBS-D, diarrea predominante | feci sfatte o acquose in ≥ 25% e feci bozzolute in < 25% delle defecazioni | |
| IBS-M (mixed), tipo misto o IBS-A (alternating) alternante | feci dure o bozzolute in ≥ 25% e feci sfatte o acquose in ≥ 25% delle defecazioni | |
| IBS-U, (unsubtyped) | anormalità delle feci non compatibili con i sottotipi IBS-C, IBS-D o IBS-M | |
I pazienti con IBS-M hanno sia feci dure che sfatte per periodi di ore o giorni, mentre i pazienti con IBS-A (alternata) cambiano sottotipo con periodi di durata più lunghi (settimane e mesi).
La forma delle feci è direttamente correlata con i tempi di transito del colon, mentre l'associazione con altre caratteristiche, come la sensibilità viscerale e la risposta al trattamento, sono ancora da determinare. La piena utilità di questi sottotipi è comunque discutibile, infatti, entro 1 anno, il 75% circa dei pazienti cambia sottotipo, e circa il 29% muta da IBS-C ad IBS-D.

Consistenza delle feci secondo la scala di Bristol
8
Per approfondire:Colore e consistenza delle feci: quando preoccuparsi?
Diagnosi
La diagnosi di colon irritabile, per definizione, si basa completamente sul contesto anamnestico (criteri di Roma III) che ha un valore predittivo positivo di circa il 98%, naturalmente deve esse affiancato dall'esame obiettivo.
Infatti, spesso, è possibile rilevare meteorismo e "corda coli" o corda colica, ovvero il riscontro di una tumefazione di forma allungata, disposta longitudinalmente, legata ad un colon abnormemente contratto, dolente alla palpazione, solitamente a livello della fossa iliaca sinistra e del fianco sinistro.
L’associazione dei gastroenterologi americani (AGA, American Gastroenterological Association) non consiglia di effettuare alcun test di laboratorio o di diagnostica per immagini nei pazienti di età inferiore ai 50 anni con sintomi tipici di IBS e senza segni o sintomi di allarme, in quanto verrebbero poste in essere indagini diagnostiche che, oltre che costose e talora invasive, otterrebbero solo di rafforzare, nel paziente, un'erroneo atteggiamento di malattia.
Le linee guida per la diagnosi di sindrome del colon irritabile
L'AGA ha elaborato delle linee guida per il corretto approccio clinico, diagnostico e terapeutico dell'IBS; di seguito riportiamo la parte che riguarda il corretto atteggiamento diagnostico da seguire:
“La diagnosi si basa sulla positiva e coerente identificazione dei sintomi, secondo i criteri di Roma, escludendo altre condizioni cliniche (diagnosi differenziale, n.d.r.) in modo "cost-effective" (economicamente efficace).
Dal punto di vista pratico sono importanti sia un'attenta anamnesi che un completo ed accurato esame obiettivo (ad es. escludere una epatomegalia, masse addominali o segni di occlusione intestinale), insieme ad alcuni esami sierologici di routine al fine di verificare e valutare l'eventuale presenza di "red flags" (bandiere rosse, segni di allarme): risveglio notturno provocato dai disturbi addominali, un cambiamento delle abitudini dell’alvo che persiste da 6 o più di settimane (specie in pz >60 anni), febbre, perdita di peso, presenza di sangue nelle feci, anemia, anamnesi familiare positiva per IBD o Neoplasie; i quali segni potrebbero richiedere una valutazione di più ampio respiro.
Si raccomanda di completare l'esame obiettivo con una esplorazione rettale, specie nei casi in cui vengono riferiti sintomi come la presenza di sangue nelle feci o l'incontinenza. È, inoltre, opportuno effettuare una routine sierologica ed una ricerca del sangue occulto fecale come screening.
Tra gli esami consigliati troviamo:
- la VES,
- il dosaggio dell'albuminemia,
- la verifica della funzionalità tiroidea,
- la ricerca di parassiti fecali e delle loro uova.
Per i pazienti che abbiano superato i 50 anni si raccomanda una colonscopia, mentre nei soggetti più giovani tale esame và effettuato solo con fondato sospetto di malattia organica (prevalentemente nella diagnosi differenziale con le IBD). Nei soggetti giovani che presentano diarrea può essere utile dosare gli anticorpi antigliadina (AGA), antiendomisio (EMA) ed antiTransGlutaminasi (AtTG), per la diagnosi della celiachia.
Nel sospetto di IBS-D può essere tentato un trattamento a base di fibre ed, in caso di scarsi/assenti risultati, occorrerà approfondire il quadro clinico con altre indagini strumentali come la manometria rettale e la defecografia (nel sospetto di SOD, Sindrome da Ostruita defecazione), o anche uno studio radiologico del transito intestinale; potranno essere utili il Breath-Test al Lattosio e/o al Lattulosio per la diagnosi dell'Intolleranza al Lattosio e della SIBO (Small Intestinal Bacterial Overgrowth).
In alcuni casi può essere opportuno ottenere dei campioni fecali di pazienti con diarrea, per determinare la eventuale presenza di una infezione da Giardia Lamblia (Giardiasi) oppure si potrà pensare di effettuare biopsie del colon per escludere una collagenopatia oppure una colite microscopica".
Come fare la diagnosi nei pazienti sotto i 50 anni?
Per quanto riguarda il riepilogo diagnostico schematico per i pazienti di età inferiore a 50 anni, le linee guida indicano quanto segue.
In tutti i pazienti di età inferiore a 50 anni e con anamnesi familiare negativa per neoplasie intestinali può essere opportuno supportare il sospetto diagnostico di IBS mediante la richiesta di:
- Esame emocromocitometrico, VES (Velocità di eritrosedimentazione), PCR (proteina C reattiva) e Sideremia. Al fine di escludere anemie e stati infiammatori.
- Esame delle urine (al fine di escludere patologie urovescicali).
- Esame delle feci (ricerca di miceti, parassiti, batteri patogeni, presenza di leucociti, tossine A e B del Clostridium difficile, ricerca dell’antigene specifico GSA 65 della Giardia Intestinalis).
- L’esecuzione di un Breath Test (test del respiro) al Lattosio ed al Lattulosio può consentire di escludere una intolleranza al Lattosio o la presenza di una SIBO (Small Intestinal Bacterial Overgrowth), ovvero una condizione in cui si rileva una eccessiva crescita (10-15 volte la norma) di batteri nel tenue.
- L'ecografia pelvica ed addominale, in virtù dell'assenza di invasività, dovrebbe essere utilizzata nei casi in cui, alla base del dolore, possono essere sospettate malattie extraintestinali.
Nelle IBS-D sarà utile richiedere:
- AGA (anticorpi anti-gliadina), EMA (anticorpi anti-endomisio), AtTG (anticorpi anti-TransGlutaminasi), al fine di escludere la Celiachia; se saranno positivi occorrerà effettuare una EGDS (EsofagoGastroDuodenoScopia) con biopsie duodenali.
- Dosaggio sierico del TSH e degli ormoni tiroidei per escludere l'ipertiroidismo.
- Nei casi in cui è presente sangue nelle feci, si dovrebbe procedere all'esecuzione di una colonscopia.
Nelle IBS-C sarà utile richiedere:
- Glicemia ed emoglobina glicosilata per escludere il diabete.
- Dosaggio del paratormone (ormone paratiroideo, PTH) per escludere l'iperparatiroidismo.
- Dosaggio sierico del TSH per escludere l'ipotiroidismo.
- Defecografia, Tempo di transito intestinale e Manometria anorettale per identificare e/o escludere altri disordini morfo-funzionali.
Per approfondire:Colon irritabile o celiachia?
Prevenzione e terapia
Qual è la strategia terapeutica per la sindrome del colon irritabile?
Impostazione del trattamento, rimedi naturali, indicazioni sulla dieta e sullo stile di vita, terapia farmacologica: nel parliamo nel prossimo articolo.
Per approfondire:Colon irritabile: quale terapia e quali diete seguire?
Approfondimenti
- Transit through the proximal colon influences stool weight in the irritable bowel syndrome
Vassallo M, Camilleri M, Phillips SF, et al.
Gastroenterology. 1992;102:102–108 - Irritable bowel syndrome, health care use, and costs: a U.S. manged care perspective
Longstreth GF, Wilson A, Knight K, et al.
Am J Gastroenterol. 2003;98:600-607 - Survey of the AGA membership relating to patients with functional gastrointestinal disorders
Mitchell, C. M., & Drossman, D. A.
Gastroenterology 1987; 92,1282-1284 - The Role of Genetics in IBS
Yuri A. Saito
Gastroenterol Clin North Am. 2011 March; 40(1): 45–67. - Genetic epidemiology and pharmacogenetics in irritable bowel syndrome
Michael Camilleri, David A. Katzka
Am J Physiol Gastrointest Liver Physiol. 2012 May 15; 302(10): G1075–G1084. - The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice
Bercik P, Denou E, Collins J, et al.
Gastroenterology 2011 Aug;141(2):599-609, 609.e1-3 - The functional gastrointestinal disorders and the Rome II process
Drossmann D.
Gut 1999;45(Suppl 2):II1-II5 - American Gastroenterological Association Medical Position Statement: Irritable Bowel Syndrome
- the official recommendations of the American Gastroenterological Association (AGA) on Irritable Bowel Syndrome-
Gastroenterology 2002;123:2105–2107 - Towards positive diagnosis of the irritable bowel
Manning AP, Thompson WG, Heaton KW, Morris AF
Br Med J 2 (6138): 653–4. (1978, september) - Functional Bowel Disorders
Longstreth G.F., et.al.
Gastroenterology (2006) 130:1480-1491 - An evidence-based position statement on the management of irritable bowel syndrome
Brandt LJ, Chey WD, Foxx-Orenstein AE, Schiller LR, Schoenfeld PS, Spiegel BM, et al.
Am J Gastroenterol. Jan 2009;104 Suppl 1:S1-35. - The fecal microbiota of irritable bowel syndrome patients differs significantly from that of healthy subjects
Kassinen A, Krogius-Kurikka L, Mäkivuokko H, Rinttilä T, Paulin L, Corander J, et al.
Gastroenterology Jul 2007;133(1):24-33. - Irritable bowel syndrome and chronic fatigue 3 years after acute giardiasis: historic cohort study
Wensaas KA, Langeland N, Hanevik K, et al.
Gut Sep 12 2011 - Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome. A double-blind, randomized, placebo-controlled study
Pimentel M, Chow EJ, Lin HC.
Am J Gastroenterol. Feb 2003;98(2):412-9 - Gluten causes gastrointestinal symptoms in subjects without celiac disease: a double-blind randomized placebo-controlled trial
Biesiekierski JR, Newnham ED, Irving PM, Barrett JS, Haines M, Doecke JD, et al.
Am J Gastroenterol. Mar 2011;106(3):508-14
Crediti immagini
- https://www.myupchar.com/en, Depiction of a person suffering from Irritable Bowel Syndrome (IBS), CC BY-SA 4.0
- Maria Henström, Mauro D’Amato, Irritable bowel syndrome factors, CC BY 4.0
- Ruthven, Quadranti addominali, CC BY-SA 4.0
- Suganya, Kanmani, and Byung-Soo Koo, Gut-Brain Axis, CC BY 4.0
- Santos Susanne Fonseca, de Oliveira Hadassa Loth, Yamada Elizabeth Sumi, Neves Bianca Cruz, Pereira Antonio, Fneur-10-00574-g001, CC BY 4.0
- Natale, Gianfranco, Larisa Ryskalin, Gabriele Morucci, Gloria Lazzeri, Alessandro Frati, and Francesco Fornai, Enteric Nervous System, CC BY 4.0
- http://www.scientificanimations.com, Irritable bowel syndrome, CC BY-SA 4.0
- Jaipasdepseudo, Bristol stool scale, CC BY-SA 4.0