Il polipo maligno (cancerizzato) del colon
Il cancro colo-rettale origina in oltre il 90% dei casi da un precursore locale benigno che è l’adenoma o polipo adenomatoso. Considerando che il tempo di passaggio da adenoma a cancro è mediamente 10-15 anni, questo ci consente di poter attuare una diagnosi precoce: l’asportazione endoscopica di tali polipi rappresenta la più valida forma di prevenzione del cancro colo-rettale in quanto interrompe la sequenza adenoma-carcinoma. Nel 2-12% degli adenomi rimossi in colonscopia è possibile riscontrare delle forme precoci di cancerizzazione dove l'endoscopia può essere risolutiva.
Indice
Cosa sono i polipi del colon?
Il tumore del colon-retto origina in oltre il 90% dei casi da un precursore locale benigno che è l'adenoma o polipo adenomatoso che nasce come piccola escrescenza, di per sé benigna, dovuta al proliferare delle cellule della mucosa intestinale.
Non tutti i polipi che troviamo nel colon, però, sono a rischio di malignità.
Ve ne sono infatti tre diversi tipi:
- i cosiddetti polipi iperplastici (cioè caratterizzati da una mucosa a rapida proliferazione),
- amartomatosi (detti anche polipi giovanili e polipi di Peutz-Jeghers) e
- adenomatosi.
Tutti i polipi del colon si trasformano in cancro?
Solo questi ultimi costituiscono lesioni precancerose e di essi solo una piccola percentuale si trasforma in neoplasia maligna attraverso delle modificazioni che vanno dalla displasia lieve a quella moderata fino alla displasia severa, che costituisce già un carcinoma (in situ), che non ha oltrepassato la membrana basale dell'epitelio intestinale.
La probabilità che un polipo del colon evolva verso una forma invasiva di cancro dipende dalla dimensione del polipo stesso:
- è minima (inferiore al 2 per cento) per dimensioni inferiori a 1,5 cm
- intermedia (2-10 per cento) per dimensioni di 1,5-2,5 cm
- è alta (10 per cento) per dimensioni maggiori di 2,5 cm.
La benignità di un polipo, quindi, è inversamente proporzionale alla sua dimensione, ma ciò non esclude che anche polipi piccoli possano essere potenzialmente maligni.
In quanto tempo il polipo evolve in forma maligna?
Considerando che il tempo di passaggio da adenoma a cancro è mediamente 10-15 anni, questo ci consente di poter attuare una diagnosi precoce e l'asportazione endoscopica di tali polipi rappresenta la più valida forma di prevenzione del cancro colo-rettale in quanto interrompe la sequenza adenoma-carcinoma.
Per approfondire:La ricerca di sangue occulto nelle feci
Polipi del colon: morfologia
Le lesioni che definiamo “polipi del colon” possono essere raggruppati in polipoidi (o protrudenti) o non polipoidi (non protrudenti o piatti).
Le formazioni polipoidi comprendono:
- Polipi peduncolati: sporgono dalla parete intestinale come un fungo con una testa ed un tronco (peduncolo) più o meno lungo (Foto 1).
- Polipi sessili sono senza peduncolo, e quindi adesi completamente alla parete del viscere (Foto 2).
- Polipi semipenducolati sono una via di mezzo fra il polipo peduncolato e quello sessile. In pratica sono forniti di una piccola base di attacco alla mucosa del colon.
Le formazioni non polipoidi comprendono.
- Polipi piatti rilevati, che sono di piccole dimensioni (< 10 mm) e non facilmente rilevabili endoscopicamente se non dopo colorazione della superficie mucosa.
- Polipi piatti rilevati “larghi” con dimensioni superiori ai 10 mm, che vengono definiti Laterally Spreading Tumors (LST), con superficie granulare o liscia (Foto 3).
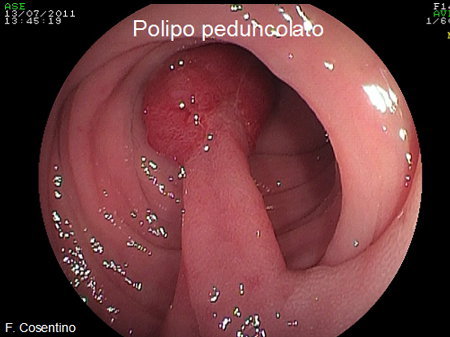
Foto 1 - Polipo peduncolato
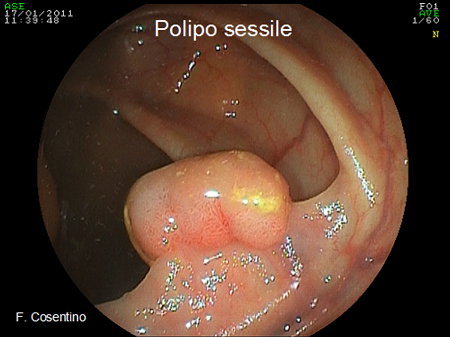
Foto 2 - Polipo sessile
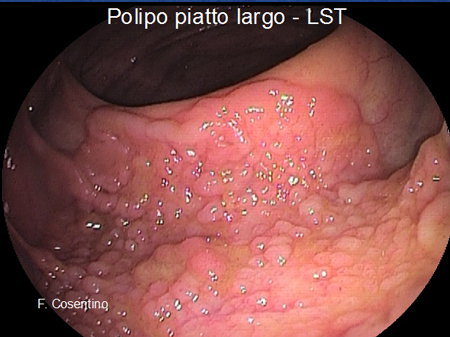
Foto 3 - Polipo piatto largo
Per approfondire:Come prepararsi alla colonscopia?
Come rimuovere i polipi del colon?
Le tecniche di asportazione del polipo sono diverse e la scelta avviene sulla base delle caratteristiche morfologiche dello stesso.
Per la corretta interpretazione delle caratteristiche istopatologiche della lesione e, soprattutto, per una sicura identificazione della cancerizzazione del polipo adenomatoso è prerequisito irrinunciabile che la polipectomia sia completa: prelievi bioptici anche multipli della testa del polipo o l'eccessiva frammentazione della lesione (con rischio di perdita di frammenti) sono del tutto inattendibili e non di aiuto nella decisione del trattamento endoscopico o chirurgico.
Asportazione con pinza
I piccoli polipi di 6-7 mm circa possono essere facilmente rimossi la pinza da biopsia. Solitamente sono necessari non più di 2-3 prese bioptiche per rimuovere completamente il tessuto (Foto 4).
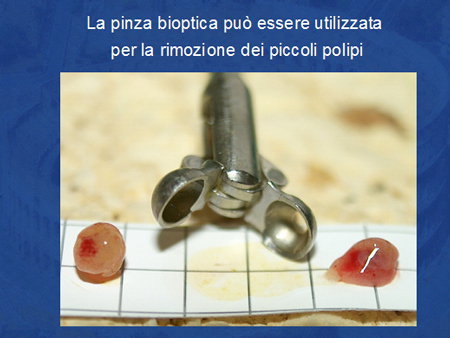
Foto 4 - Pinza da biopsia
Asportazione con pinza “a caldo” (hot biopsy)
Si tratta di una tecnica di rimozione dei piccoli polipi con una pinza che consente contemporaneamente l'ettrocoagulazione.
Una volta afferrato il polipo con la pinza si fa passare la corrente che consente l'asportazione della lesione e la contemporanea coagulazione della zona di taglio (Foto 5).
E’ una tecnica ormai in disuso per i rischi (perforazione, emorragia) che può comportare.
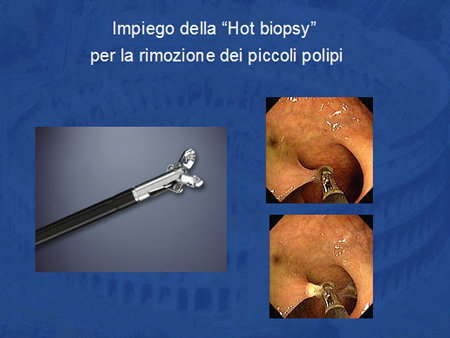
Foto 5 - Hot Biopsy
Asportazione con ansa a “freddo” (cold snare polipectomy)
È un'altra tecnica per rimuovere i piccoli polipi che consiste nella sezione meccanica di tali formazioni utilizzando la classica ansa da polipectomia ma senza l’impiego della corrente di coagulazione.
I vantaggi sono quelli di ottenere la rimozione completa dei polipi senza i rischi dell'impiego della corrente di coagulazione (emorragia, perforazione).
Asportazione con ansa ed elettrocoagulazione
Si tratta della classica polipectomia. L'ansa viene stretta attorno al penducolo che viene sezionato grazie al passaggio della corrente di coagulazione o mista (taglio e coagulazione, Foto 6).
La tecnica è variabile in base alle dimensioni ed alla sede del polipo. In caso di polipi con grosso peduncolo questo può essere preliminarmente stretto alla base con un loop di nylon prima della sezione con ansa (Foto 7).
Tale modalità evita il rischio di sanguinamento più frequente nella sezione dei grossi polipi peduncolati.
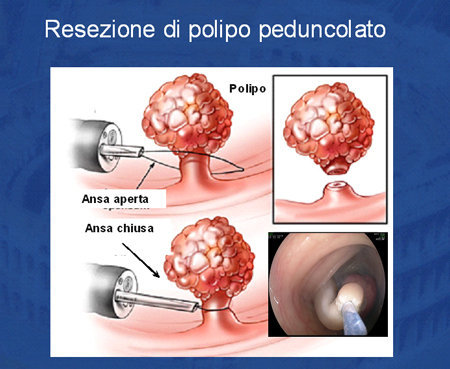
Foto 6 - Tecnica della sezione con ansa del polipo peducolato.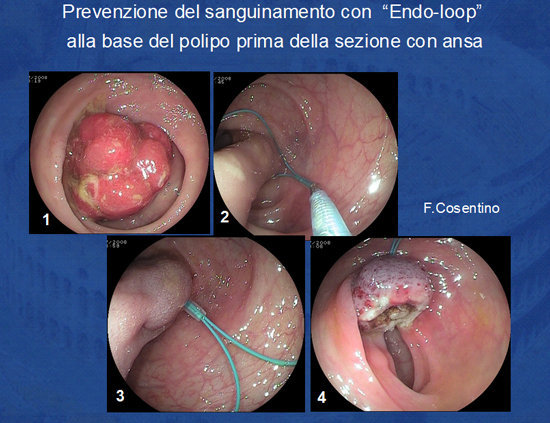
Foto 7: Utilizzo dell'Endo-Lop per la prevenzione del sanguinamento nella rimozione dei grossi polipi peduncolati.
👉🏻L'esperto risponde: Polipo peduncolato sul retto: cosa devo fare?
Resezione della mucosa (Endoscopic Mucosal Resection – EMR)
La differenza sostanziale fra l'EMR e la polipectomia classica consiste nel fatto che mentre la polipectomia ha lo scopo di rimuovere le formazioni rilevate, e quindi incarcerabili con l'ansa, l'EMR viene impiegata per le lesioni cosiddette “piatte” o comunque scarsamente rilevate sul piano mucoso e, quindi, non facilmente aggredibili con la semplice ansa diatermica.
Oltre alla mucosa viene rimossa uno strato della sottomucosa in modo da inviare una porzione di tessuto idonea per lo studio istopatologico.
Prima di procedere alla rimozione della lesione piatta l'endoscopista si avvale delle tecniche di cromoendoscopia naturale o elettronica (NBI, FICE) e dell'alta definizione endoscopica in modo da definire i limiti della lesione e di studiare i “pit patterns” ghiandolari altamente specifici per presenza di malignità nella sottomucosa del polipo (Foto 8 e 9).
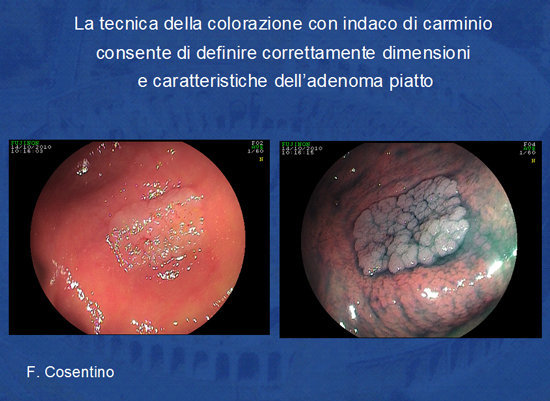
Foto 8 - Adenoma piatto prima e dopo colorazione con indaco di carminio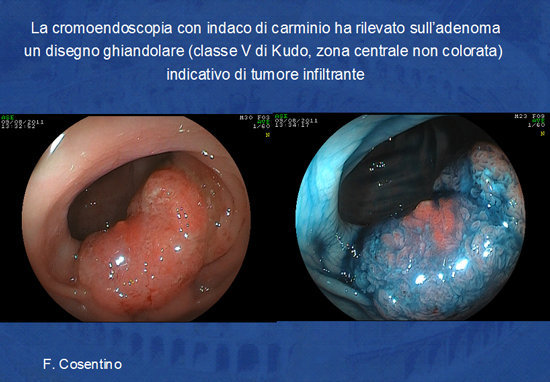
Foto 9 - Impiego dell'indaco di carminio e dell'alta definizione endoscopica (Fuji) per definire
le caratteristiche di benignità o di malignità dell'adenoma (secondo i criteri di Kudo).
La tecnica della mucosectomia consiste nell'infiltrazione della sottomucosa con sostanze specifiche (soluzione di fisiologica, glucosata ipertonica, acido ialuronico, ecc.) in modo da “scollare” la lesione dai piani sottostanti.
Si crea così un cuscinetto di tessuto che può essere incarcerato con l'ansa ed asportato con una (en bloc) o più sezioni (piecemeal) (Foto 10).
Tale tecnica, in mani esperte, consente la rimozione di vasti adenomi (oltre i 5 cm) (Foto 11).
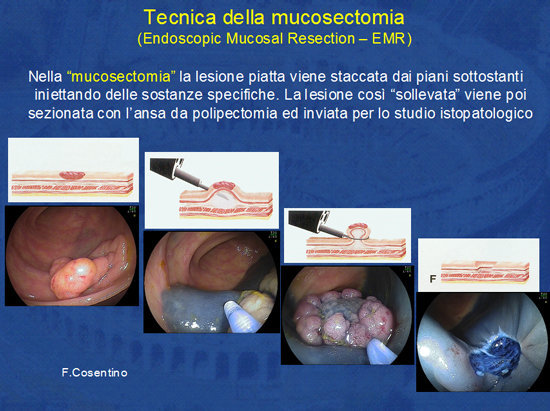
Foto 10 - Tecnica della mucosectomia (EMR).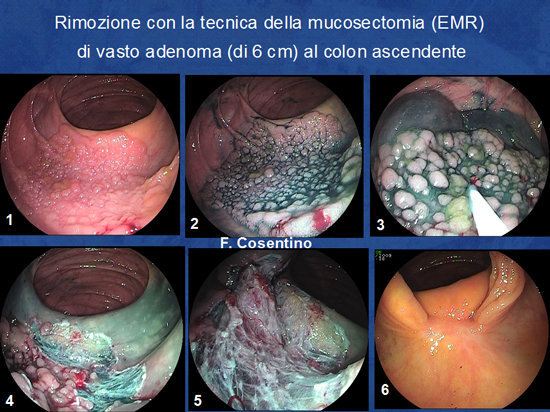
Foto 11: Rimozione con tecnica della mucosectomia di adenoma piatto di 6 cm a ridosso della valvola ileo-ciecale. L'immagine n° 6 mostra la completa guarigione al controllo dopo 3 mesi
(esame istologico: adenoma tubulare con displasia grave).
Un variante della EMR è la dissezione della sottomucosa (Endoscopic Submucosa Dissection – ESD) che consiste nel taglio, con accessori specifici, della sottomucosa e nell'asportazione in toto di grossi polipi piatti.
La tecnica, anche se ha il vantaggio di inviare all'istopatologo la lesione per intero, è di difficile esecuzione, di lunga durata e gravata da alte complicanze (sanguinamento, perforazione). Per tale motivo viene preferita la tecnica EMR per la rimozione delle lesioni piatte.
Come fare la diagnosi?
Una volta asportato il polipo questo deve essere sottoposto ad esame istopatologico allo scopo di definire lo stato di benignità o malignità della lesione e quindi la decisione di considerare definitivo l'intervento endoscopico o dover ricorrere, invece, all'intervento chirurgico di resezione del colon.
La diagnosi istopatologica si basa sulla istologia architetturale, sulla valutazione del grado di displasia, sull'eventuale presenza di carcinoma (adenoma cancerizzato), specificando i fattori predittivi di metastatizzazione, e lo stato del margine di resezione.
Definizione istologica
La valutazione istologica dell'adenoma è finalizzata al riconoscimento di una significativa componente villosa, essendo tale tipo di architettura correlata al potenziale di trasformazione maligna del polipo e, soprattutto, di sviluppo di lesioni adenomatose colorettali sincrone e/o metacrone.
I tre tipi istologici sono:
- tubulare,
- tubulo-villoso,
- villoso.
Grading della displasia
Negli adenomi colorettali la displasia è graduata in lieve, moderata e grave.
L'accorpamento, da parte di alcuni patologi dei vari gradi in due sole categorie:
- basso grado (lieve e moderata),
- alto grado (grave) può trovare ragione in considerazione della scarsa riproducibilità della distinzione tra lieve e moderata.
Nel contesto della displasia grave a volte vengono identificate strutture epiteliali complesse costituite da cellule meno differenziate e più polimorfe che sono spesso riportate come carcinoma in situ.
Un altro termine che viene riportato (in presenza di un'infiltrazione neoplastica limitata alla tonaca propria o che dissocia, ma senza superarla, la muscolaris mucosae) è il carcinoma intramucoso.
Dal punto di vista istologico entrambe le definizioni sono corrette, ma siccome il carcinoma in situ e, nel grosso intestino, anche il carcinoma intramucoso sono privi di potenzialità metastatica, tali termini rientrano nella definizione di displasia grave.
Qualora tali definizioni dovessero essere ugualmente riportate su un referto bisogna tenere conto che si tratta di lesioni prive di malignità biologica per cui non c'è necessita di ulteriore trattamento.
Per approfondire:Tumore del colon retto: prevenzione primaria e secondaria
L'adenoma cancerizzato del colon
Tale dizione è riservata agli adenomi in cui il tessuto neoplastico abbia superato la muscularis mucosae infiltrando la sottomucosa dove sono presenti vasi venosi e linfatici responsabili della diffusione locale e a distanza delle cellule tumorali (metastasi).
È la forma più precoce di carcinoma colorettale (pT1 sec. TNM), dotata di potenziale metastatico linfonodale (variabile fra 0,3-37%) e lo si riscontra nel 2-12% degli adenomi rimossi in colonscopia.
Nella foto 12 con lo stadio 1 è indicata la lesione localizzata all'interno della mucosa, per cui il trattamento endoscopico è considerato terapeutico e definitivo.
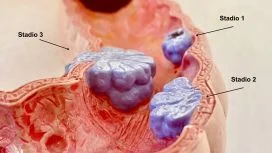
Foto 12 - Schema illustrativo dei diversi stadi della lesione maligna e della
corrispondente diffusione metastatica attraverso i vasi linfatici e venosi.
Nello stadio 2 la lesione ha già infiltrato la sottomucosa. In tale stadio si configura l'adenoma cancerizzato il cui trattamento può essere endoscopio o chirurgico (in base ai criteri esposti sotto).
Negli stadi successivi assistiamo ad un'infiltrazione progressiva degli strati più profondi della parete (con conseguente diffusione metastatica) per cui si parla di carcinoma invasivo ed il trattamento è di esclusiva pertinenza chirurgica.
Scelta terapeutica
Nella decisione della successiva scelta terapeutica (resezione chirurgica vs follow-up clinico-endoscopico), bisogna tenere conto dei seguenti parametri istologici:
- grado istologico di differenziazione del carcinoma:
il grading viene distinto in:- Grado I ben differenziato,
- Grado II moderatamente differenziato,
- Grado III indifferenziato.
Ai fini dell'indirizzo terapeutico si parla di: Basso Grado (G1 e G2) ed Alto Grado (G3).
- infiltrazione neoplastica dei vasi linfatici o venosi che può essere assente, focale, discreta, massiva;
- “budding” tumorale:
descrive la presenza di cellule di carcinoma isolate o disposte in gruppi di meno di 5 elementi nello stroma del margine di avanzamento tumorale:- basso grado (0-9 focolai di budding ad un ingrandimento 250x) vs
- alto grado (10 o più focolai a 250x);
- stato del margine di resezione endoscopica:
positivo quando si identifichino cellule di carcinoma a meno di 1 mm dal margine, o entro la banda di diatermocoagulazione; - microstadiazione:
- Rapporto Percentuale Tessuto Adenomatoso/Adenocarcinoma. valutazione quantitativa del rapporto percentuale tra tessuto adenomatoso e carcinomatoso (lesioni con piccoli volumi di carcinoma invasivo hanno potenziale metastatico più basso dei polipi costituiti in prevalenza da carcinoma invasivo).
- Livello di infiltrazione del peduncolo (terzo superficiale-medio-profondo, Livelli di Haggitt) e di invasione della sottomucosa negli adenomi cancerizzati sessili (sm1, sm2, sm3).
- Misurazione microscopica (micron) della massima profondità ed ampiezza di invasione
La presenza di almeno uno dei parametri istologici dei punti tra 1 e 4 caratterizza l'adenoma cancerizzato ad alto rischio di progressione neoplastica.
La microstadiazione consente di evidenziare, nell'ambito delle lesioni a basso rischio, un sottogruppo di adenomi cancerizzati in cui il potenziale metastatico linfonodale è prossimo allo zero:
- profondità di invasione < 300 mm;
- profondità di invasione < 2000 mm associato ad ampiezza massima < 4000 mm in assenza di budding tumorale.
Adenoma cancerizzato: livelli di rischio metastatico
Da un'analisi della letteratura, (38 studi per un totale di 1900 pazienti con adenoma cancerizzato) si confermano i 3 principali criteri di rischio di diffusione metastatica:
- infiltrazione del margine di resezione
- scarso grado di differenzazione del cancro
- infiltrazione linfo-vascolare
Sulla valutazione di tali criteri è possibile differenziare gli adenomi cancerizzati a basso rischio e ad alto rischio:
Polipo cancerizzato a “basso rischio” di metastasi
- grading G1-G2;
- margine a più di 1 mm dalla infiltrazione.
- non invasione vascolare (ematica e/o linfatica);
- polipo peduncolato con infiltrazione limitata al livello 1 e 2 sec. Haggit;
- Non polipectomia “piecemeal” (ossia, non a frammenti)
Polipo cancerizzato ad “alto rischio” di metastasi
- grading G3
- infiltrazione a meno di 1 mm dal margine;
- Invasione vascolare
- polipo maligno peduncolato con infiltrazione del livello 3-4 sec. Haggit
- polipo maligno sessile;
- polipectomia “piecemeal”
Per le forme a basso rischio la diffusione metastatica è inferiore all'1% (0,3% per adenomi maligni peduncolati e 1% per gli adenomi maligni sessili), mentre nelle forme ad alto rischio la diffusione supera il 10%.
Bisogna comunque sottolineare che, per quanto i polipi cancerizzati a basso rischio siano associati ad un rischio di metastasi basso, tale possibilità è tuttavia presente.
Anche se con la microstadiazione possiamo definire la categoria di pazienti con un rischio “vicino allo zero”, la possibilità di metastasi, anche se minima, esiste.
I pazienti devono, quindi, essere informati di tale rischio residuo come pure devono essere informati sul rischio delle complicanze chirurgiche e, soprattutto, sulla mortalità (2% nei soggetti superiori a 70 anni).
Se, invece, ci troviamo di fronte, ad un polipo cancerizzato ad alto rischio in questo caso la possibilità di metastasi è superiore al 10% per cui il trattamento non può essere che chirurgico. A meno che il paziente non abbia importanti malattie associate che controindicano o rendano a rischio elevato l'intervento.
In ogni caso si tratta sempre di una decisione importante ed il paziente non può essere lasciato solo. Questa, infatti, è una decisione collegiale fra endoscopista, anatomopatologo, chirurgo e paziente.
L'endoscopista deve essere certo di aver rimosso interamente il polipo e aver recuperato tutti i frammenti. Tale condizione è molto importante soprattutto quando viene asportato un adenoma piatto con tecnica “piece-meal” ossia a frammenti.
Il mancato recupero di un frammento (dove teoricamente ci potrebbe essere l'infiltrazione profonda della neoplasia) pone l'indicazione chirurgica.
L'endoscopista deve poi informare il paziente sui futuri controlli endoscopici a cui sottoporsi.
L'anatomatologo ha un ruolo fondamentale in quanto è proprio la sua descrizione istopatologica che influenzerà la decisione se ritenere il trattamento endoscopico definitivo o se optare per la soluzione chirurgica. Quindi è importante che tale descrizione risponda ai criteri già esposti.
Il chirurgo deve informare il paziente sul tipo d'intervento (per via laparotomica, laparoscopica, o per via trans rettale); sulla possibile durata della degenza e sui rischi (complicanze e mortalità) connessi all'atto chirurgico.
Il paziente, una volta che è stato correttamente informato sui pro e contro delle due soluzioni, deve prendere una decisione. In questo, ovviamente, non sarà lasciato solo, ma il medico di riferimento saprà indicargli, in base alla sua esperienza (confortata da quella scientifica) quale potrebbe essere l'intervento migliore.
Bisogna, inoltre, che il paziente sia al corrente della possibilità, in caso di situazioni dubbie e complesse legate all'interpretazione istologica, di poter chiedere un secondo parere con altro specialista anatomopatologo, come viene suggerito nei protocolli dello screening nazionale del cancro colo rettale.
Riferimenti
- C. Hassan - Dis Colon Rectum 2005; 48: 1588-1596
- M. Risio – Pathologica 2006; 98171-174
- NHS Cancer Sreening Programms 2007 – www.cancerscreening.nhs.uk
- European Commission: European guidelines for quality assurance in colorectal cancer screening and diagnosis 2010